CDISC는 국내 임상시험 데이터 표준화의 핵심 요소로, 데이터 표준화가 필수적인 신약 개발 산업에서 중요한 역할을 하고 있다. 미국 FDA와 일본 PMDA에서 신약 승인을 위해 임상시험 데이터를 전자문서로 제출할 때 CDISC 적용을 의무화하고 있으며, 국내에서도 CDISC 적용 필요성에 대한 목소리가 커지고 있다.
이번 워크샵은 CDISC에 대한 LSK Global PS 통계부서의 전문 지식과 업무 활용 노하우를 실무자들에게 공유하는 자리를 마련하고자 기획됐다. LSK Global PS는 우수한 수준의 CDISC 역량을 보유한 임상시험수탁기관(Contract Research Organization, 이하 CRO)으로, 미국 FDA와 유럽 EMA에서 의무화가 시작된 2010년에 선제적으로 CDISC SDTM/ADaM 서비스 개시하고, 2011년부터 본격적으로 업무를 수행해 왔다. 박병관 LSK Global PS 부사장은 현재 K3C(CDISC 한국본부) 회장을 역임하며 CDISC 본사와 긴밀한 관계를 유지하고, 이를 통해 국내에서 CDISC의 실질적인 확산과 다각적인 파트너쉽 구축을 위해 노력하고 있다.
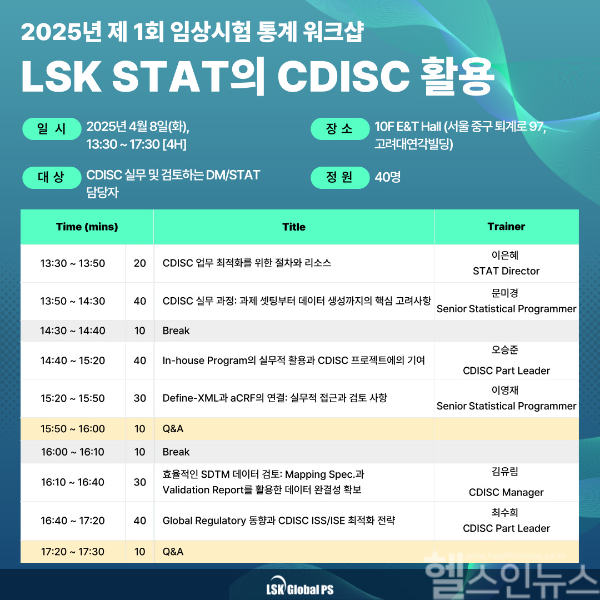
이번 워크샵은 유료이며 CDISC 실무 및 검토하는 DM/STAT 담당자를 대상으로 정원 40명 선착순으로 진행된다. 참여자 신청은 다음달 2일까지 LSK Global PS 교육센터 공식 웹사이트를 통해 가능하다.
한편 LSK Global PS 통계부서는 올해 CDISC 활용 워크샵 이외에도 통계 실무 워크샵, 통계 웨비나, 식품의약품안전처 CDISC 제출 시범 사업 참여 등 임상시험 통계 및 CDISC 관련 활동을 다수 진행할 예정이다. 올해 하반기에는 ARS 본부와 통계부서 공동으로 임상시험 통계 실무에서의 다양한 주제로 유료 워크샵을 계획하고 있다.
김국주 헬스인뉴스 기자 press@healthinnews.kr
김국주 기자
press@healthinnews.kr


